اسید سولفوریک
اسید سولفوریک چیست؟
اسید سولفوریک در فرآیند کاتالیزوری که ابتدا در دهه 1830 ابداع شد از دی اکسید گوگرد ساخته می شود اما نتیجه همان است - یک اسید قوی که بسیار خورنده است و هنگام مخلوط کردن با آن مقدار زیادی گرما ایجاد می کند. به همین دلیل است که اسید سولفوریک باید همیشه به جای روش دیگر به آب اضافه شود تا اطمینان حاصل شود که شما مقدار کمی از آب را در مقدار زیادی اسید سولفوریک دریافت نمی کنید و در نتیجه باعث جوشیدن فلش و پاشیدن با مایع خورنده می شود.
در این واکنش تولید گرما ، اسید و آب یونهای سولفات و هیدروونیوم را تشکیل می دهند. اسید سولفوریک در گرفتن آب برای واکنش به این روش بسیار عالی است. به همین دلیل است که اسید سولفوریک غلیظ کاغذ را سیاه می کند - این ماده هیدروژن و اکسیژن را از نشاسته موجود در کاغذ استخراج می کند و کربن خالص باقی می گذارد. اثرات مشابهی را می توان با سایر ترکیبات آلی تولید کرد.
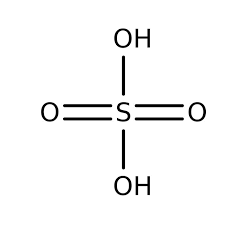
اسید سولفوریک نقش مهمی در تولید کود و مواد شوینده در صنعت دارد و در آنجا برای استخراج فسفات از سنگها استفاده می شود. این نیز راه خود را به مجموعه فرایندهای صنعتی از بین بردن خوردگی فلزات تا ساختن رنگها می رساند. بیشتر ما حتی مقداری اسید سولفوریک نیز داریم ، گرچه در جایی که بندرت آن را می بینیم یافت شده است.
باتری های اتومبیل دارای اسید سولفوریک در قلب خود هستند (در واقع سولفوریک بعضا اسید باتری نامیده می شود). در واکنش الکترولیتی که الکترودهای باتری ، سرب و اکسید سرب را به سولفات سرب تبدیل می کند ، در نتیجه بار الکتریکی از صفحه به صفحه دیگر جریان می یابد.
اسید سولفوریک ماده خوبی نیست. اسید سولفوریک باعث سوختگی شدید و آسیب شدید پوست و چشم می شود. با این وجود سخت بودن کاملاً شیشه ای در مورد ماده ای که اتومبیل ها را در حرکت نگه داشته و کودهای اساسی به ما می دهد دشوار است. حداقل ما یک چیز را می دانیم. اسید سولفوریک ممکن است گاهی اوقات بیهوده باشد .
اسید سولفوریک به دلیل کاربردهای بیشمار به عنوان یک ماده خام یا ماده فرآوری کننده ، اغلب به عنوان "ماده شیمیایی جهانی" و "شیمیایی که باعث ایجاد مواد شیمیایی می شود" شناخته می شود.
اسید سولفوریک از طریق احتراق گوگرد عنصری (S ) برای تشکیل دی اکسید گوگرد (SO2) تولید می شود. SO2 از طریق اکسیداسیون کاتالیزوری به تری اکسید گوگرد (SO3) تبدیل می شود.

SO3 سپس با جذب در اسید سولفوریک غلیظ (H2SO4) با آب واکنش نشان می دهد.
استفاده گسترده از اسید سولفوریک به دلیل چندین عامل مهم است:
کم هزینه
نوسانات کم
توانایی عمل به عنوان یک عامل اکسید کننده قوی
توانایی عمل به عنوان یک ماده مرطوب کننده قوی
خواص اسیدی قوی اسید سولفوریک
برنامه های کاربردی اسید سولفوریک (H2SO4):
· مواد شیمیایی کشاورزی
· سولفات آلومینیوم
· باتری
· سلفون
· مواد شوینده
· مواد منفجره
· کود
· گازوئیل
· علف کش ها
· سوخت موشک
· نفت سفید
· چرم
· روغن های روان کننده
· فرآیندهای دارویی
· مواد افزودنی روغن
· کاغذ
· ریون و لاستیک
· قند
· الیاف مصنوعی
· داروهای دامپزشکی
· تصفیه آب
· رنگدانه های زرد